Atommodelle
| Ernest Rutherford (1911) | nicht eingeloggt |
Rutherfords Atommodell - das Kern-Hülle-Modell
Informationen:
Ernest Rutherford
Ernest Rutherford, 1. Baron Rutherford of Nelson (* 30. August 1871 in Brightwater bei Nelson/Neuseeland; † 19. Oktober 1937 in Cambridge) war ein neuseeländischer, in England wissenschaftlich arbeitender Atomphysiker, der 1908 den Nobelpreis für Chemie erhielt. Er war seit 1931 Baron Rutherford of Nelson.
Leben
Ernest Rutherford war der Sohn von James Rutherford, einem Bauern aus Perth (Schottland) und Martha Thompson aus Hornchurch (Essex). Die Eltern wanderten nach Neuseeland aus, um Flachs und eine Menge Kinder großzuziehen
.
Ernest Rutherford studierte am Canterbury College in Christchurch, heute die University of Canterbury. 1898 erhielt er einen Ruf an die McGill-Universität
in Montréal (Kanada), wo er bis 1907 arbeitete. Für die Forschungen, die er in dieser Zeit leistete, erhielt er im Jahre 1908 den Nobelpreis für Chemie. Danach begann er an der Universität Manchester in England zu lehren, wo er unter anderem mit späteren Nobelpreisträgern wie Niels Bohr und Patrick Blackett, Baron Blackett arbeitete. 1919 ging er als Professor nach Cambridge, wo er Direktor des Cavendish-Laboratoriums
war. 1921 erschien seine Schrift Nuclear Constitution of Atoms (dt.: Über die Kernstruktur der Atome). 1924 wurde er zum Ritter geschlagen und 1931 zum Baron ernannt. 1925–1930 war er Präsident der Royal Society (Königliche Gesellschaft). Lord Rutherford wurde in der Westminster Abbey in London nahe dem Grab von Isaac Newton beigesetzt. Zu seinen Ehren wurde 1997 das Element 104 als Rutherfordium benannt, ebenso wie der Asteroid (1249) Rutherfordia.
Leistungen
Rutherford gilt als einer der bedeutendsten Experimentalphysiker. Bereits 1897 erkannte er, dass die ionisierende Strahlung des Urans aus mehreren Teilchenarten besteht.
1902 stellte er die Hypothese auf, dass chemische Elemente durch radioaktiven Zerfall in Elemente mit niedrigerer Ordnungszahl übergehen. Er teilte 1903 die Radioaktivität in Alphastrahlung, Betastrahlung sowie Gammastrahlung nach der positiven, negativen oder neutralen Ablenkung der Strahlenteilchen in einem Magnetfeld auf und führte den Begriff der Halbwertszeit ein. Diese Arbeit wurde 1908 mit dem Nobelpreis für Chemie ausgezeichnet.
Sein bekanntester Beitrag zur Atomphysik ist das Rutherfordsche Atommodell, das er 1911 aus seinen Streuversuchen von Alphateilchen an Goldfolie ableitete. Rutherford widerlegte das Atommodell von Thomson, der noch von einer gleichmäßigen Masseverteilung ausgegangen war.
Danach war er der Erste, der experimentell nachwies (1919), dass durch Bestrahlung mit Alphateilchen ein Atomkern (in seinem Falle Stickstoff) in einen anderen (in seinem Falle in das nächst schwere Element Sauerstoff) umgewandelt werden kann. Bei diesen Experimenten entdeckte er das Proton.
Unter seiner Anleitung zertrümmerten
John Cockcroft und Ernest Walton das erste Mal mit künstlich beschleunigten Teilchen einen Atomkern; mit Protonen beschossenes Lithium
spaltete sich in zwei Alphateilchen, also Helium-Kerne,
auf. Einem weiteren Wissenschaftler in Cambridge, James Chadwick, gelang es 1932, das Neutron experimentell nachzuweisen, welches Rutherford bereits Jahre vorher theoretisch postuliert hatte.
Der Streuversuch
Die Rutherford-Streuung
beschreibt die Streuung von geladenen Partikeln an einem geladenen Streuzentrum. Im Ausgangsversuch wurde die Streuung von Alpha-Teilchen
an Gold-Atomkernen
untersucht. Die sich daraus ergebenden Teilchenbahnen sind Hyperbeln. Die Verteilung der gestreuten Teilchen lässt auf die Struktur des Streuzentrums rückschließen. Dies führte zur Erkenntnis, dass die positive Ladung in den Atomen sich auf einen kleinen Raum im Atomzentrum konzentriert. Bis dahin galt das Modell von J.J. Thomson, bei dem die positive Ladung des Atoms homogen in einer Kugel verteilt ist (thomsonsches Atommodell). Beteiligt an diesen Experimenten waren Hans Geiger, Ernest Marsden und Ernest Rutherford. Bei der Betrachtung der Messergebnisse, die darauf hinweisen, dass die Masse des Atoms in einem kleinen Kern konzentriert ist, soll Rutherford gesagt haben: Dies ist so unwahrscheinlich, als ob man mit einer Pistole auf einen Wattebausch schießt, und die Kugel zurückprallt.
Rutherfordscher Streuversuch (Manchester, 1909)
Aufbau und Durchführung
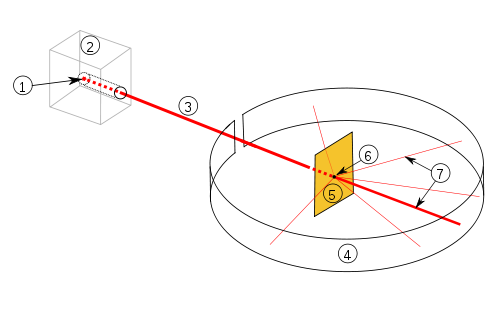
Quelle: Wikipedia
In einen Blei-Block mit Öffnung zu einer Seite hin wird ein radioaktiver Stoff gelegt, der Strahlung abgibt: Alpha-, Beta- und Gamma-Strahlung. Diese Strahlen werden durch die Öffnung im Bleiblock durch ein elektrisches Feld geleitet. Die Beta-Strahlen lenkt man zum positiven Pol hin ab, die Alpha-Strahlen zum negativen Pol und die Gamma-Strahlen bleiben unverändert. Die Alpha-Strahlung wird durch eine (ca. 2000 Atome) dünne Goldfolie geleitet. Die Strahlung lässt sich danach mit einem Leuchtschirm sichtbar machen. Es wurde Gold verwendet, da es sich schon damals mit einfachen mechanischen Mitteln zu sehr dünnen Schichten verarbeiten ließ und eine hohe Atommasse besitzt.
Beobachtung
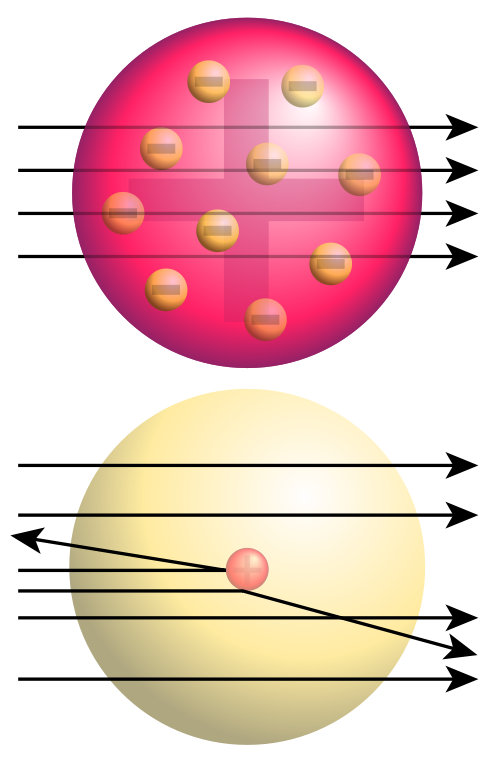
Abb. oben: erwartetes Ergebnis nach dem Thomsonschen Atommodell
Abb. unten: beobachtetes Ergebnis
- Der Großteil der Alpha-Teilchen kann die Goldfolie (mehr oder weniger) ungehindert passieren.
- Größere Streuwinkel kommen immer seltener vor, je größer der Winkel ist.
- Auch Streuwinkel von über 90° gibt es, aber extrem selten.
- Einige Alpha-Teilchen werden zurück gestreut.
- Die Verteilung entspricht der Rutherfordschen Streuformel.
- Wenn die Alpha-Teilchen auf den Kern eines Atoms der Goldfolie stoßen, werden sie zurückgeworfen, dies erklärt die an manchen Stellen strahlenden Punkte.
Interpretation
Die Ablenkung der Alpha-Teilchen und ihre Winkelverteilung lassen sich dadurch verstehen, dass sich in den Atomen ein sehr kleines Massezentrum befindet, das elektrisch geladen ist. Man nennt dieses Massezentrum den Atomkern. Die meisten Strahlen sind durch die Goldfolie gekommen, d.h. dass zwischen den Kernen ein großer Freiraum besteht. Das Ergebnis führte auf das rutherfordsche Atommodell. Die Elektronen, welche um den Kern kreisen, schirmen die positive Kern-Ladung ab, sodass das Atom nach außen hin neutral erscheint.
Ernest Rutherford:

Quelle: Wikipedia