Informationen zum Element: Arsen
| Chemische Daten, Vorkommen, Verwendung, Bilder | nicht eingeloggt |
Steckbrief: Arsen
Informationen zum Element:
Bezeichnung
Symbol: As
Internationale Bezeichung (IUPAC): Arsenic
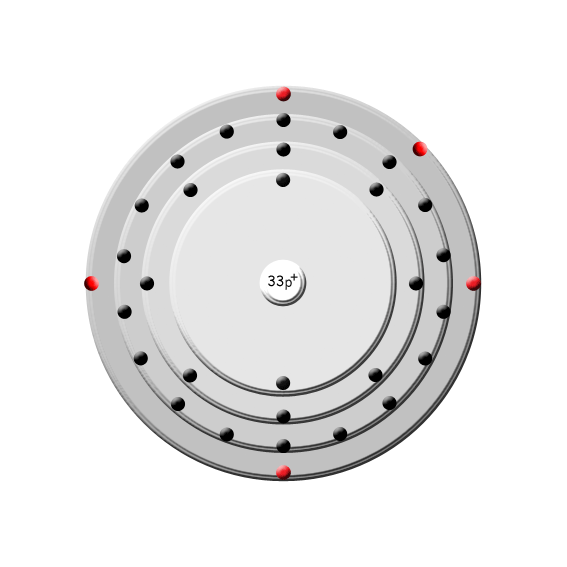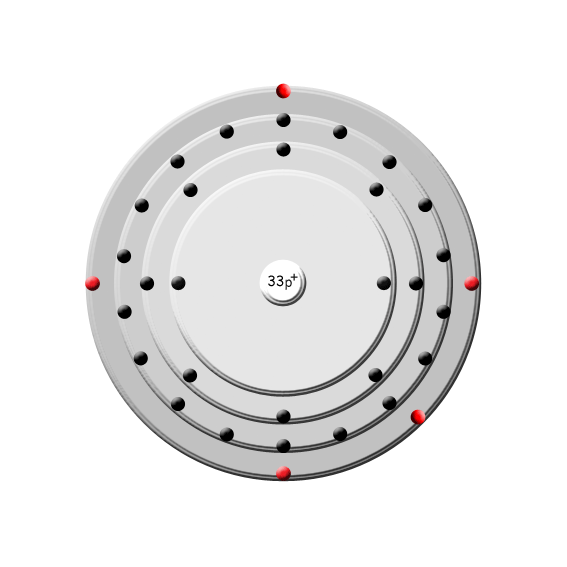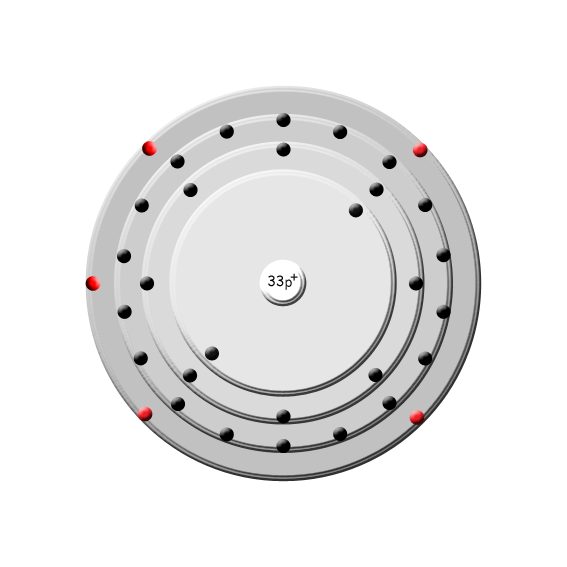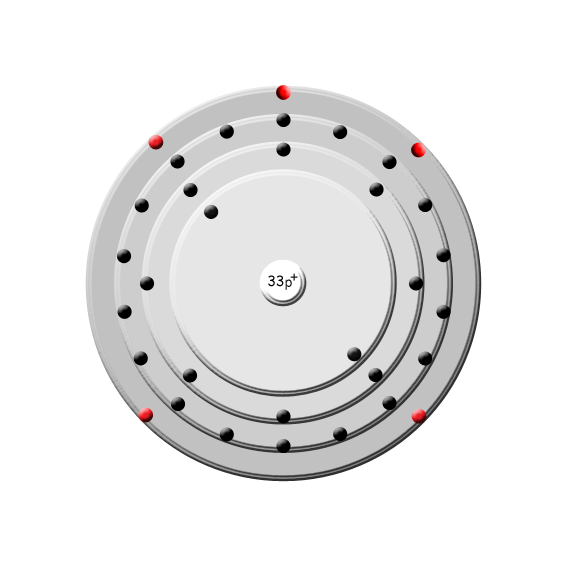
Ursprung: Arsen ist das chemische Element mit der Ordnungszahl 33. Im Periodensystem der Elemente ist es unter dem Symbol As in der 5. Hauptgruppe, der Stickstoffgruppe, zu finden. Arsen kommt selten gediegen, meistens in Form von Sulfiden vor. Es gehört zu den Halbmetallen, da es je nach Modifikation metallische oder nichtmetallische Eigenschaften zeigt.
Arsenverbindungen kennt man schon seit dem Altertum. Obwohl sie hochgradig giftig sind, finden sie Verwendung als Bestandteil einzelner Arzneimittel. Arsen wird auch zur Dotierung von Halbleitern und als Bestandteil von III-V-Halbleitern wie Galliumarsenid genutzt.
Der Name Arsen geht unmittelbar auf das griechische arsenikón zurück, die Bezeichnung des Arsenminerals Auripigment. Sie findet sich schon bei Dioskurides im 1. Jahrhundert. Die griechische Bezeichnung scheint ihrerseits ihren Ursprung im Mittelpersischen al-zarnik (goldfarben) zu haben und gelangte wohl durch semitische Vermittlung ins Griechische. Volksetymologisch wurde der Name fälschlicherweise vom griechischen Wort arsenikós abgeleitet, das sich etwa mit männlich/stark übersetzen lässt. Erst seit dem 19. Jahrhundert ist die Bezeichnung Arsen gebräuchlich. Das Elementsymbol wurde 1814 von Jöns Jakob Berzelius vorgeschlagen.
Der erste Kontakt von Menschen mit Arsen lässt sich aus dem 3. Jahrtausend v. Chr. nachweisen ? in den Haaren der im Gletschereis erhaltenen Mumie eines volkstümlich Ötzi genannten Alpenbewohners ließen sich größere Mengen Arsen nachweisen, was archäologisch als Hinweis darauf gedeutet wird, dass der betroffene Mann in der Kupferverarbeitung tätig war ? Kupfererze sind oft mit Arsen verunreinigt.
Im klassischen Altertum war Arsen in Form der Arsen-Sulfide Auripigment (As2S3) und Realgar (As4S4) bekannt, die etwa von dem Griechen Theophrastos, dem Nachfolger Aristoteles, beschrieben wurden. Auch der griechische Philosoph Demokrit hatte im 2. Jahrhundert v. Chr. nachweislich Kenntnisse über Arsenverbindungen. Der Leidener Papyrus aus dem 3. Jahrhundert nach Chr. lässt darauf schließen, dass sie benutzt wurden, um Silber goldartig und Kupfer weiß zu färben. Der römische Kaiser Caligula hatte angeblich bereits im 1. Jahrhundert nach Chr. ein Projekt zur Herstellung von Gold aus dem (goldgelben) Auripigment in Auftrag gegeben. Die Alchimisten, die Arsen-Verbindungen nachweislich der Erwähnung im antiken Standardwerk Physica et Mystica kannten, vermuteten eine Verwandtschaft mit Schwefel und Quecksilber. Arsen(III)-sulfid kam als Malerfarbe und Enthaarungsmittel zum Einsatz sowie zur äußerlichen als auch inneren Behandlung von Lungenkrankheiten.
Im Mittelalter wurde Arsenik (Arsen(III)-oxid) im Hüttenrauch (staubbeladenes Abgas metallurgischer Öfen) gefunden. Albertus Magnus beschrieb um 1250 erstmals die Herstellung von Arsen durch Reduktion von Arsenik mit Kohle. Er gilt daher traditionell als Entdecker des Elements, auch wenn es Hinweise darauf gibt, dass das elementare Metall schon früher hergestellt wurde. Paracelsus führte es im 16. Jahrhundert in die Heilkunde ein. Etwa zur gleichen Zeit wurden Arsenpräparate auch in der chinesischen Enzyklopädie Pen-ts' ao Kan-mu des Apothekers Li Shi-zhen beschrieben; der Autor hebt insbesondere die Anwendung als Pestizid in Reisfeldern hervor.
Im 17. Jahrhundert wurde das gelbe Auripigment bei holländischen Malern als Königsgelb populär; moderne Restauratoren werden durch die Tatsache, dass sich das Pigment über längere Zeiträume hinweg in Arsen(III)-oxid umwandelt und von der Leinwand abbröckelt, allerdings herausgefordert.
Ab 1740 wurden Arsenpräparate in Europa mit Erfolg als Beizmittel im Pflanzenschutz eingesetzt; diese Nutzung verbot man jedoch 1808 wegen ihrer hohen Toxizität wieder. Anwendungen beim Bleiguss, insbesondere für Gewehrkugeln folgten.
Trotz der unrühmlichen Bedeutung des Arseniks als Mordgift war Arsen im beginnenden 19. Jahrhundert eines der bedeutendsten Asthmamittel. Man berief sich dabei anscheinend auf Berichte, in denen den Chinesen nachgesagt wurde, sie würden Arsen in Kombination mit Tabak rauchen, um Lungen zu bekommen, die stark wie Blasebälge seien.
Zu dieser Zeit wurde es in Form von Kupferarsenaten auch in Farbstoffen wie dem Pariser Grün eingesetzt, mit denen Tapeten bedruckt wurden. Bei hoher Feuchtigkeit wurden diese Pigmente durch Schimmelpilzbefall in giftige flüchtige Arsenverbindungen umgewandelt, die nicht selten zu chronischen Arsenvergiftungen führten. Der frühzeitige Tod des französischen Kaisers Napoléon Bonaparte im Exil auf St. Helena ist wahrscheinlich aber nicht auf eine Vergiftung mit dem aus den Tapeten freigesetzten Arsen zurückzuführen sondern auf Magenkrebs. Noch in den 1950er Jahren auf dem Höhepunkt des Kalten Krieges erkrankte die US-amerikanische Botschafterin, Clare Booth Luce, in Rom aus demselben Grund ? die Tatsache, dass die Krankheit auf die schimmelpilzbefallenen Tapeten und nicht auf gegnerische Geheimagenten zurückgeführt werden konnte, trug in diesem Fall nicht nur zur Genesung der Botschafterin, sondern auch zum Erhalt des Friedens bei.
Im Jahre 1900 kam es im britischen Manchester zu einer Massenvergiftung, von der mehrere Tausend Menschen betroffen waren. Wie sich herausstellte, hatten alle Bier derselben Brauerei getrunken. In Vorstufen der Bierproduktion wurde anscheinend Schwefelsäure eingesetzt, die ihrerseits aus Schwefel hergestellt wurde, der aus mit Arsenopyrit kontaminierten Sulfidmineralen stammte. Etwa 70 Menschen erlagen ihren Vergiftungen.
Doch auch in Kriegen fand Arsen Verwendung: Im Ersten Weltkrieg wurden Arsenverbindungen in chemischen Kampfstoffen wie Blaukreuz oder Lewisit eingesetzt; bei den betroffenen Opfern bewirkten sie durch Angriff auf Haut und Lungen grausame Schmerzen und schwerste körperliche Schädigungen.
Bedeutung: arsenikón = Mineralname / goldfarben / männlich-stark
Daten Periodensystem
Periode: 4
Gruppe: 15 (V A)
Gruppenname: Stickstoffgruppe
Oxidationszahl: 3 (5, -3)
Atommasse [u]: 72,64
Elektronegativität
Elektronegativität (nach Allred): 2,2
Elektronegativität (nach Pauling): 2,18
Physikalische Daten

Aggregatzustand (20°C): fest
Dichte [g/cm2]: 5,323
Radioativ: n
Schmelztemperatur [°C]: 817 (bei 27,5 bar)
Siedetemperatur [°C]: 614
Kristallstruktur: rhombohedral
Verwendung im Alltag
- Eigenschaften: Arsen bildet zusammen mit Stickstoff, Phosphor, Antimon und Bismut die 5. Hauptgruppe des Periodensystems. Wegen seiner physikalischen und chemischen Eigenschaften nimmt es einen Mittelplatz in dieser Elementgruppe ein. Arsen hat eine relative Atommasse von 74,92159. Der Radius des Arsen-Atoms beträgt 124,5 Picometer. In kovalent gebundenem Zustand ist er etwas kleiner (121 Picometer). Aufgrund der Abgabe der äußeren Elektronen (Valenzelektronen) bei der Ionisierung reduziert sich der Radius beträchtlich auf 34 Picometer (As5+; das äußerste p- und s-Orbital bleibt unbesetzt) beziehungsweise 58 Picometer (As3+; nur das p-Orbital ist unbesetzt). In chemischen Komplexverbindungen ist das As5+-Kation von vier Bindungspartnern (Liganden), As3+ von sechs umgeben. Arsen tritt allerdings nur sehr selten in eindeutig ionischer Form auf.
Der Wert für die Elektronegativität liegt nach Pauling auf der von 0 (Metalle) bis 4 (Nichtmetall) reichenden Skala bei 2,18 und ist damit mit dem Wert des Gruppennachbarn Phosphor vergleichbar. Der Halbmetall-Charakter des Arsens zeigt sich zudem darin, dass die benötigte Dissoziationsenergie von 302,7 kJ/mol, also die Energie, die aufgebracht werden muss, um ein einzelnes Arsen-Atom aus einem Arsen-Festkörper herauszulösen, zwischen der des Nichtmetalls Stickstoff (473,02 kJ/mol; kovalente Bindung) und des Metalls Bismut (207,2 kJ/mol; metallische Bindung) liegt. Unter Normaldruck sublimiert Arsen bei einer Temperatur von 616 °C, geht also aus dem festen Aggregatzustand direkt in die Gasphase über. Arsendampf ist zitronengelb und setzt sich bis ungefähr 800 °C aus As4-Molekülen zusammen. Oberhalb von 1700 °C liegen As2-Moleküle vor.
Arsen zeigt je nach Verbindungspartner Oxidationsstufen zwischen -3 und +5. Mit elektropositiven Elementen wie Wasserstoff oder Metallen bildet es Verbindungen, in denen es eine Oxidationsstufe von -3 einnimmt. Beispiele dafür sind Monoarsan (AsH3) und Arsenkupfer (Cu3As). In Verbindungen mit elektronegativen Elementen wie den Nichtmetallen Sauerstoff, Schwefel und Chlor besitzt es die Oxidationstufe +3 oder +5; erstere ist dabei gegenüber den in derselben Hauptgruppe stehenden Elementen Stickstoff und Phosphor tendenziell bevorzugt. - Modifikationen: Arsen kommt wie andere Elemente der Stickstoffgruppe in verschiedenen allotropen Modifikationen vor. Anders als beim Stickstoff, der in Form zweiatomiger Moleküle mit kovalenter Dreifachbindung vorkommt, sind die entsprechenden As2-Moleküle instabil; Arsen bildet stattdessen kovalente Netzwerke aus.
Graues Arsen
: Graues oder metallisches Arsen ist die stabilste Form. Es hat eine Dichte von 5720 kg/m3. Seine Kristalle sind stahlgrau, metallisch glänzend und leiten den elektrischen Strom.
Betrachtet man den strukturellen Aufbau des grauen Arsens, dann erkennt man Schichten aus gewellten Arsen-Sechsringen, welche die so genannte Sesselkonformation einnehmen. Darin bilden die Arsen-Atome eine Doppelschicht, wenn man sich den Aufbau der Schicht im Querschnitt ansieht. Die Übereinanderlagerung dieser Doppelschichten ist sehr kompakt. Bestimmte Atome der nächsten darüberliegenden oder darunterliegenden Schicht sind von einem Bezugsatom fast ähnlich weit entfernt wie innerhalb der betrachteten Doppelschicht. Dieser Aufbau bewirkt, dass die graue Arsen-Modifikation wie die homologen Elemente Antimon und Bismut sehr spröde ist. Deswegen werden diese drei Elemente häufig auch als Sprödmetalle bezeichnet.Gelbes Arsen
: Wird Arsen-Dampf, in dem Arsen gewöhnlich als As4-Tetraeder vorliegt, schnell abgekühlt, so bildet sich das metastabile gelbe Arsen mit einer Dichte von 1970 kg/m3. Es besteht ebenfalls aus tetraedrischen As4-Molekülen. Gelbes Arsen ist ein Nichtmetall und leitet infolgedessen den elektrischen Strom nicht. Es kristallisiert aus Schwefelkohlenstoff und bildet kubische, stark lichtbrechende Kristalle, die nach Knoblauch riechen. Bei Raumtemperatur und besonders schnell unter Lichteinwirkung wandelt sich gelbes Arsen in graues Arsen um.Schwarzes Arsen
: Schwarzes Arsen selbst kann seinerseits in zwei verschiedenen Modifikationen vorkommen. Amorphes schwarzes Arsen entsteht durch Abkühlung von Arsen-Dampf an 100 bis 200 °C warmen Oberflächen. Es besitzt keine geordnete Struktur, sondern liegt in einer amorphen, glasartigen Form vor, analog zum roten Phosphor. Die Dichte beträgt 4700 bis 5100 kg/m3. Oberhalb 270 °C wandelt sich das schwarze Arsen in die graue Modifikation um. Wird glasartiges, amorphes schwarzes Arsen bei Anwesenheit von metallischem Quecksilber auf 100 bis 175 °C erhitzt, so entsteht das metastabile orthorhombische schwarze Arsen, das mit dem schwarzen Phosphor vergleichbar ist.Braunes Arsen
: Bei der Reduktion von Arsenverbindungen in wässriger Lösung entstehen ähnlich wie beim Phosphor Mischpolymerisate. Bei diesen bindet ein Teil der freien Valenzen des Arsens Hydroxylgruppen (-OH). Man nennt diese Form des Arsens braunes Arsen.
- Verwendung: Arsen wird Bleilegierungen zugesetzt, um ihre Festigkeit zu verbessern und das Blei gießbar zu machen. Vor allem die fein strukturierten Platten von Akkumulatoren könnten ohne Arsen nicht gegossen werden.
Historisch war Arsen eine wichtige Zutat von Kupferlegierungen, die dadurch besser verarbeitbar wurden.
Metallisches Arsen wurde früher gelegentlich zur Erzeugung mattgrauer Oberflächen auf Metallteilen verwendet, um eine Alterung vorzutäuschen.
In der Elektronik spielt es als mindestens 99,9999 Prozent reines Element für Gallium-Arsenid-Halbleiter, so genannte III-V-Halbleiter (aufgrund der Kombination von Elementen aus der 3. und 5. Hauptgruppe des Periodensystems), sowie für Epitaxieschichten auf Wafern in Form von Indiumarsenidphosphid und Galliumarsenidphosphid eine wesentliche Rolle in der Herstellung von Hochfrequenzbauelementen wie Integrierten Schaltkreisen (ICs), Leuchtdioden (LEDs) beziehungsweise Laserdioden (LDs). Es gibt Anfang 2004 weltweit nur drei Hersteller von hochreinem Arsen, zwei in Deutschland und einen in Japan.
Arsen wird in Form seiner Verbindungen in einigen Ländern als Schädlingsbekämpfungsmittel im Weinbau, als Fungizid (Antipilzmittel) in der Holzwirtschaft, als Holzschutzmittel, als Rattengift und als Entfärbungsmittel in der Glasherstellung verwendet. Der Einsatz ist sehr umstritten, da die eingesetzten Arsenverbindungen (hauptsächlich Arsen(III)-oxid) hoch toxisch sind. - Arsen in Arzneimitteln: Die Verwendung arsenhaltiger Mineralien als Heilmittel ist bereits durch die Autoren der Antike, Hippocrates und Plinius, bezeugt. Sie wurden als Fiebermittel, als Stärkungsmittel und zur Therapie von Migräne, Rheumatismus, Malaria, Tuberkulose und Diabetes eingesetzt. Im 18. Jahrhundert wurde eine Mischung aus Kaliumarsenit und Lavendelwasser als Fowler'sche Lösung bekannt, die lange als medizinisches Wundermittel galt und als Fiebersenker, Heilwasser und sogar als Aphrodisiakum Anwendung fand. Kaliumarsenit war als Bestandteil der Fowler'schen Lösung bis in die 1960er Jahre in Deutschland als Mittel zur Behandlung der Psoriasis im Einsatz.
Einen Aufschwung erlebten arsenhaltige Arzneimittel am Anfang des 20. Jahrhunderts. Harold Wolferstan Thomas und Anton Breinl konnten 1905 beobachten, dass das arsenhaltige Präparat Atoxyl Trypanosomen, die Erreger der Schlafkrankheit, abtötet. 1920 wurde eine Weiterentwicklung, das Tryparsamid, im tropischen Afrika in der Zeit von 1922 bis 1970 zur Therapie der Schlafkrankheit eingesetzt. Es war der Eckpfeiler in der Eingrenzung dieser Epidemie in der ersten Hälfte des vorigen Jahrhunderts, konnte jedoch zur Erblindung führen. Das in den 1950er Jahren entwickelte Melarsoprol war über mehrere Jahrzehnte das Mittel der ersten Wahl zur Behandlung der Schlafkrankheit und wird heute noch eingesetzt, da keine effektiven Nachfolgepräparate zur Verfügung stehen.
Ebenfalls angeregt durch die Trypanosomen-toxische Wirkung von Atoxyl entwickelte Paul Ehrlich das arsenhaltige Arsphenamin. Das 1910 in die Therapie der Syphilis eingeführte Mittel stellte die erste antibiotisch wirksame Substanz dar und war Vorbild für die Entwicklung der bis heute verwendeten Sulfonamide. Es wurde lange Zeit auch bei der Behandlung von Dysenterie eingesetzt.
Im Jahr 2000 wurde ein arsenikhaltiges Präparat unter dem Namen Trisenox in den USA zur Behandlung der promyelozytären Leukämie (APL) zugelassen. Seit 2002 besteht für Trisenox auch in Europa eine Zulassung zur Behandlung der APL, (Vertrieb in EU und USA: Cephalon). Seine Wirksamkeit bei der Krebstherapie wird auch auf die antiangioneogenetische Wirkung zurückgeführt.
Die verschiedenen Arsensulfide sind Bestandteil von Arzneimitteln der Chinesischen Medizin. Arsenicum album spielt in der Homöopathie eine wichtige Rolle, es ist eines der sogenannten Polychreste (häufig verordnete Arzneimittel).
Vorkommen und Häufigkeit
Vorkommen: Arsen kommt praktisch überall im Boden in geringen Konzentrationen von bis zu 10 ppm vor. Es ist in der Erdkruste ungefähr so häufig wie Beryllium und Germanium. Von 1 Millionen Massenanteilen sind dort 1,5 dem Arsen zuzuordnen; damit liegt Arsen in der Tabelle der häufigsten Elemente an 53. Stelle.
Selten ist es gediegen als Scherbenkobalt zu finden, als elementares Mineral findet es sich in massiver Form unter anderem in Deutschland, im Harz (St. Andreasberg), im Erzgebirge (Freiberg), Frankreich, Italien, den USA und im russischen Sibirien. Häufiger sind intermetallische Verbindungen mit Antimon (Allemontit) und Kupfer (Whitneyit). Meistens trifft man Arsen gebunden in Form von Sulfiden, vermengt mit anderen Sulfiderzen an. Die verbreitetsten Arsensulfide sind Realgar (As4S4), Auripigment (As2S3) und das wichtigste Arsenerz Arsenkies (FeAsS), das auch als Arsenopyrit bezeichnet wird. Daneben findet man Cobaltit ((Co,Fe)AsS), Lichtes Rotglüherz (Ag3AsS3), Gersdorffit, Arsenkupfer (Cu3As), Löllingit, Enargit (Cu3AsS4), Rammelsbergit sowie Safflorit und Sperrylit. Arsenate finden sich häufig in phosphathaltigen Gesteinen, da sie eine vergleichbare Löslichkeit aufweisen.
Die Hauptvorkommen der verwertbaren Arsenerze liegen heute in Russland, Schweden, Frankreich, Mexiko und Chile. Trotzdem wird Arsen hauptsächlich im Rahmen der Förderung anderer Metallerze wie Kupfer, Blei oder Cobalt, aber auch durch Phosphatabbau gewonnen. 1986 wurden in der Welt etwa 48.000 Tonnen Arsen in Form von As2O3 produziert. Laut World Mineral Statistics von 1988 nahm Schweden mit einer Produktionsleistung von 10.000 Tonnen weltweit die Spitzenposition ein, gefolgt von der damaligen UdSSR (8100 Tonnen), Frankreich (8000 Tonnen), Mexiko und Chile (je 6000 Tonnen). Weitere Produzenten waren Kanada (5100 Tonnen), Namibia (2200 Tonnen) und Peru (1200 Tonnen). Deutschland kam 1988 auf 360 Tonnen. Die Weltvorräte an Arsen werden auf über 10 Millionen Tonnen geschätzt.
Arsen ist nur schwer wasserlöslich und findet sich daher nur in geringen Spuren, etwa 1,6 ppb (Milliardstel Massenanteilen) in Meeren und Ozeanen.
In der Luft findet man Arsen in Form von partikulärem Arsen(III)-oxid. Als natürliche Ursache dafür hat man Vulkanausbrüche identifiziert, die insgesamt geschätzte 3000 Tonnen in die Atmosphäre eintragen. Bakterien setzen weitere 20.000 Tonnen in Form organischer Arsenverbindungen wie Trimethylarsin frei. Ein großer Teil am freigesetzten Arsen entstammt auch der Verbrennung fossiler Brennstoffe wie etwa Kohle oder Erdöl. Die geschätzten Emissionen, verursacht durch den Straßenverkehr und stationäre Quellen, betrugen 1990 in der Bundesrepublik Deutschland 120 Tonnen (20 Tonnen in den alten, 100 Tonnen in den neuen Bundesländern). Die Außenluftkonzentration von Arsen liegen zwischen 0,5 bis 15 Nanogramm pro Kubikmeter.
Häufigkeit: 6,00 ⋅ 10-4 % (prozentualer Massenanteil der Erdhülle, d.h. der Erdkruste/Ozeane bis 16 km Tiefe)
Geschichte
Entdeckung: ---
Entdecker: historisch
Isotope
- 75As (100 %, stabil, 42 Neutronen)
Bild (mit freundlicher Genehmigung von http://www.smart-elements.com):