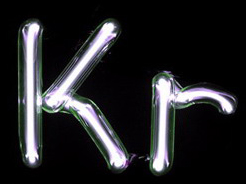Informationen zum Element: Krypton
| Chemische Daten, Vorkommen, Verwendung, Bilder | nicht eingeloggt |
Steckbrief: Krypton
Informationen zum Element:
Bezeichnung
Symbol: Kr
Internationale Bezeichung (IUPAC): Krypton
Ursprung: Krypton (von altgriech. kryptós verborgen
) ist ein chemisches Element im Periodensystem der Elemente mit dem Symbol Kr und der Ordnungszahl 36. Das farblose und ungiftige Edelgas kommt in geringer Konzentration (etwa 1:1.000.000) in der Luft vor.
Krypton (griechisch krypton für versteckt) wurde am 30. Mai 1898 von William Ramsay und Morris William Travers im Rückstand
verdampfter Luft entdeckt.
Von 1960 bis 1983 diente die 1.650.763,73-fache Wellenlänge der orange-roten Spektrallinie des Isotops Krypton-86 als Definition der Längeneinheit Meter. Grund war, dass Krypton-86 recht einfach in hinreichend reiner Form aus Luft gewonnen werden konnte.
Bedeutung: kryptós = verborgen
Daten Periodensystem
Periode: 4
Gruppe: 18 (VIII A)
Gruppenname: Edelgase
Oxidationszahl: 2
Atommasse [u]: 83,798
Elektronegativität
Elektronegativität (nach Allred):
Elektronegativität (nach Pauling):
Physikalische Daten

Aggregatzustand (20°C): gasförmig
Dichte [g/cm2]: 0,003733
Radioativ: n
Schmelztemperatur [°C]: -157
Siedetemperatur [°C]: -153
Kristallstruktur: kubisch - flächenzentriert
Verwendung im Alltag
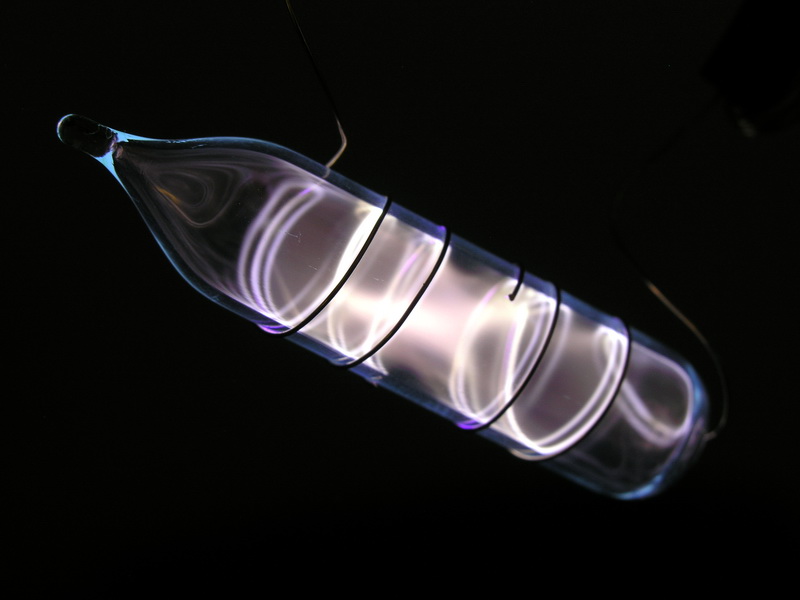
- Eigenschaften: Krypton ist im gasförmigen und flüssigen Zustand farblos, im festen Zustand weiß und kristallin. In Wasser ist es etwas löslich. In Gasentladungsröhren leuchtet Krypton je nach dem innerem Gasdruck in unterschiedlichen Farben: violett, blau, hellblau, gelbgrün.
Als Edelgas mit einer vollständig aufgefüllten Valenzschale ist es chemisch sehr träge. Mit dem stark elektronegativen Fluor konnte ein instabiles Kryptondifluorid KrF2 gebildet werden, welches das stärkste bisher bekannte Oxidationsmittel ist.
Der kritische Punkt stellt sich ein bei:- Temperatur: -63,75 °C (=209,4 K)
- Druck: 55,0 bar
- Dichte: 0,908 g/cm3
- Isotope: Von Krypton sind 25 Isotope und 4 Kernisomere mit Massezahlen von 71 bis 95 bekannt. Fünf der Kryptonisotope sind stabil. Das radioaktive Isotop 78Kr hat mit 2,0 x 1021 (2 Trilliarden) Jahren durch doppelten Elektroneneinfang eine so lange Halbwertszeit, dass es einen kleinen Anteil des natürlich vorkommenden Kryptons ausmacht, ohne dass dieses dadurch nennenswert radioaktiv würde. Außerdem kommt 81Kr mit 229.000 Jahren Halbwertszeit in Spuren in der Erdatmosphäre vor. Daneben hat noch 85Kr mit 10,756 Jahren eine relativ lange Halbwertszeit. Da es in Kernreaktoren als Spaltprodukt entsteht, gelangt es bei der Wiederaufarbeitung von Kernbrennstäben in die Atmosphäre. Die restlichen Isotope und Kernisomere haben Halbwertszeiten zwischen 64 ms und 35,04 Stunden.
- Anwendungen: In der Technik wird es überwiegend zum Füllen von Glühlampen genutzt:
- Glühlampen (Kryptonlampen)
- Halogenlampen (in denen es grün-violett leuchtet)
- Niederdruck-Quecksilberdampflampen
- Fotoblitzbirnen
- Weitere Anwendungen:
- Chemische Laser mit Kryptonfluorid (KrF)
- Krypton-Ionen-Laser
- Oxidationsmittel Kryptondifluorid (KrF2)
- Krypton wird bei Isoliergläsern anstelle von Argon im Scheibenzwischenraum [SZR] eingesetzt, weil es ein schlechter Wärmeleiter ist. Krypton hat bei 6–8 mm SZR den besten Ug-Wert (Wärmedurchgangskoeffizient, früher k-Wert) und liegt verglichen mit ca. 14 mm Argon um ca. 0,1 W/(m2K) niedriger.
- Füllung für Geiger-Müller-Zählrohre und Szintillationszähler
- als 81mKryptongas in der Nuklearmedizin als Nuklid für die Lungenszintigrafie
Vorkommen und Häufigkeit
Vorkommen: Krypton ist Bestandteil der Lufthülle. Wegen der geringen Konzentration von ca. 1,1 ml/m3 ist die Gewinnung von reinem Krypton sehr aufwendig und langwierig. Krypton ist mit 0,1 ppb in der kontinentalen Erdkruste vertreten. Es steht hinter Rhenium und vor Xenon an der 82 Stelle der Elementhäufigkeit und ist somit das zweit seltenste nicht radioaktive Element.
Häufigkeit: 2,00 ⋅ 10-8 % (prozentualer Massenanteil der Erdhülle, d.h. der Erdkruste/Ozeane bis 16 km Tiefe)
Geschichte
Entdeckung: 1898
Entdecker: William Ramsay und Morris William Travers
Isotope
- 78Kr (0,35 %, radioaktiv, Halbwertszeit: 2,0 ⋅ 1021 a, 42 Neutronen)
- 80Kr (2,25 %, stabil, 44 Neutronen)
- 82Kr (11,6 %, stabil, 46 Neutronen)
- 83Kr (11,5 %, stabil, 47 Neutronen)
- 84Kr (57,0 %, stabil, 48 Neutronen)
- 86Kr (17,3 %, stabil, 50 Neutronen)
Bilder (mit freundlicher Genehmigung von http://www.smart-elements.com):