Informationen:
Elemente
|
|
|
|
|
| [209,99]85 At |
| Astat |
| [8,3 h]
|
|
| | Metall |
| Nichtmetall |
| Halbmetall |
| Lanthanoide |
| Actinoide |
| Künstliche Elemente |
| Feststoff (bei 20 °C) |
Flüssigkeit (bei 20 °C) |
Gas (bei 20 °C) |
[Halbwertszeit] |
Zu den Halogenen gehören die Elemente Fluor, Chlor, Brom, Iod und das äußerst seltene radioaktive
Element Astat. Die erstgenannten vier stabilen Elemente spielen wichtige Rollen in Chemie, Biologie
und Medizin. Astat dient in organischen Verbindungen in der Nuklearmedizin zur Bestrahlung bösartiger
Tumore. Die Elemente der direkten Nachbargruppen werden einerseits als Chalkogene und andererseits
als Edelgase bezeichnet.
Herkunft des Namens
Als Halogene (Salzbildner
, von agr. halos
= Salz
und gennáo
= erzeugen
)
werden die Elemente der 7. Hauptgruppe (17. Gruppe) des Periodensystems der chemischen Elemente bezeichnet.
Diese Nichtmetalle sind im elementaren Zustand sehr reaktionsfreudig (Fluor kann Brände auslösen), farbig
und reagieren mit Metallen zu Salzen (Namensherkunft) und mit Wasserstoff unter Normalbedingung zu
Halogenwasserstoffen (gasförmige, einprotonige Säuren).
Physikalische Eigenschaften
Elementare Halogene sind farbige, leicht flüchtige bis gasförmige Substanzen, die in Wasser löslich
sind (Fluor reagiert). Ihre Farbkraft, Siedetemperatur und Dichte nehmen mit der Ordnungszahl zu,
die Giftigkeit (Toxizität) ab. Sie liegen in Form von zweiatomigen Molekülen der Form X2 vor
(z. B. F2 und Cl2) und sind daher Nichtleiter (Isolatoren).
Chemische Eigenschaften
Halogene sind sehr reaktionsfreudige Nichtmetalle, da ihnen nur noch ein einziges Valenzelektron zur
Vollbesetzung der Valenzschale fehlt. Da die Halogen-Halogen-Bindung nicht sehr stabil ist, reagieren
auch Halogenmoleküle heftig; die Reaktivität nimmt, wie die Elektronegativität, von Fluor zu Iod ab.
Gleichzeitig steigt die 1. Ionisierungsenergie nach oben hin an. Die Eigenschaften von Astat sind jedoch
größtenteils unerforscht, wahrscheinlich ist es aber aus chemischer Sicht dem Iod sehr ähnlich.
- Halogene reagieren mit Metallen unter Bildung von Salzen, was ihnen ihren Namen einbrachte.
Beispiel: Bildung von Kochsalz (NaCl): 2 Na + Cl2 --> 2 NaCl
- Halogene reagieren exotherm mit Wasserstoff unter Bildung von Halogenwasserstoffen, die, in Wasser
gelöst, mehr oder weniger starke Säuren sind. Die Heftigkeit der Reaktion nimmt von Fluor zu Iod ab.
Beispiel: Chlorknallgasreaktion: H2 + Cl2 --> 2 HCl
- Die Wasserlöslichkeit der Halogene nimmt von Fluor zu Iod ab, wobei Fluor mit Wasser unter
Bildung von Fluorwasserstoff und Sauerstoff reagiert.
F2 + 2 H2O --> 4 HF + O2
- Die Farbintensität im gasförmigen Aggregatzustand steigt mit zunehmender Ordnungszahl.
- Dichte, Schmelz- und Siedepunkt nehmen aufgrund der Zunahme der Molmasse von oben nach unten zu.
Bei Standardbedingungen sind Fluor und Chlor Gase, Brom ist eine Flüssigkeit und Iod fest.
Quelle:
http://de.wikipedia.org/wiki/Halogene
Halogene:
| Schalenmodell (nach Bohr) | Bild (aus www.smart-elements.com) | Daten |

|
| Fluor | |
| Kein Bild vorhanden. | | Name: | Fluor |
| Ordnungszahl: | 9 |
| Atommasse: | 18,998 u |
| Dichte: | 0,001696 g/cm3 |
| Schmelzpunkt: | ~-219,55 °C |
| Siedepunkt: | ~-188,12 °C |
|

|
| Chlor | |
| 
Bild (zur Verfügung gestellt von www.smart-elements.com) | | Name: | Chlor |
| Ordnungszahl: | 17 |
| Atommasse: | 35,453 u |
| Dichte: | 0,003214 g/cm3 |
| Schmelzpunkt: | -101 °C |
| Siedepunkt: | -34 °C |
|
|
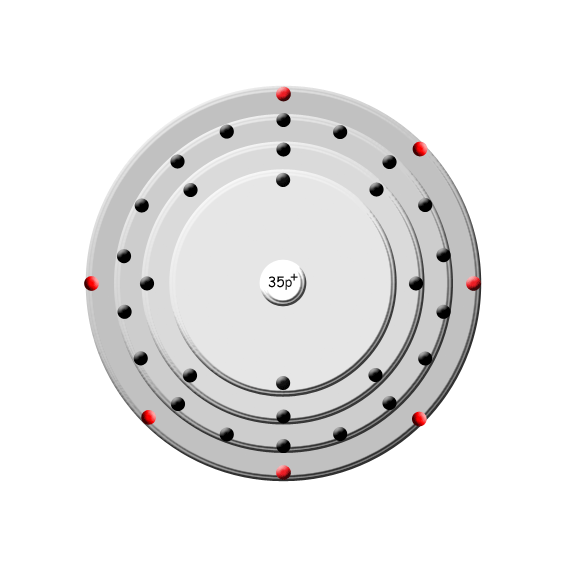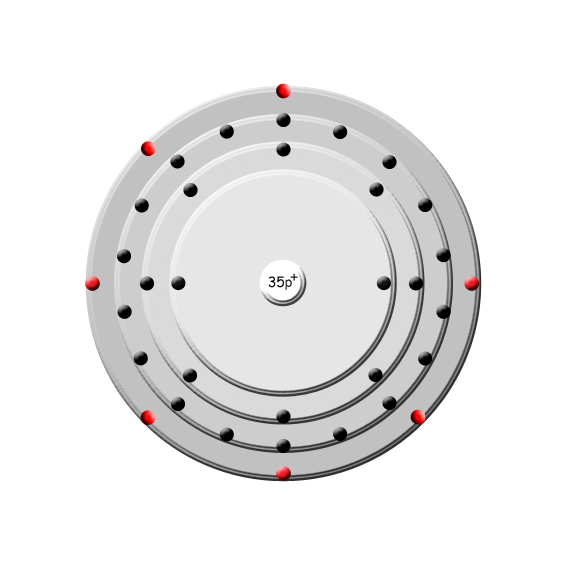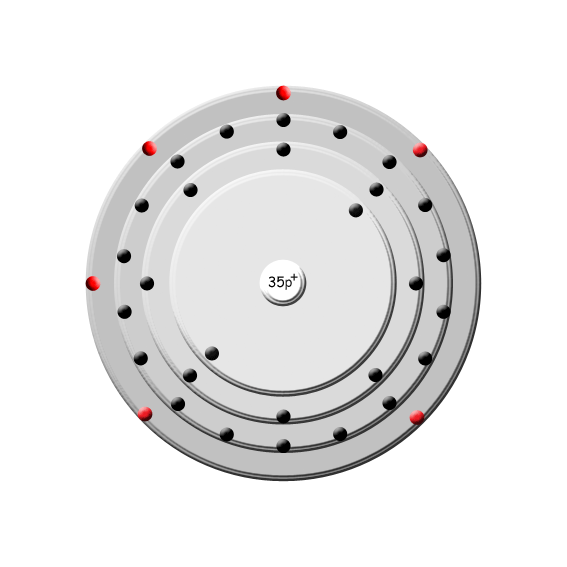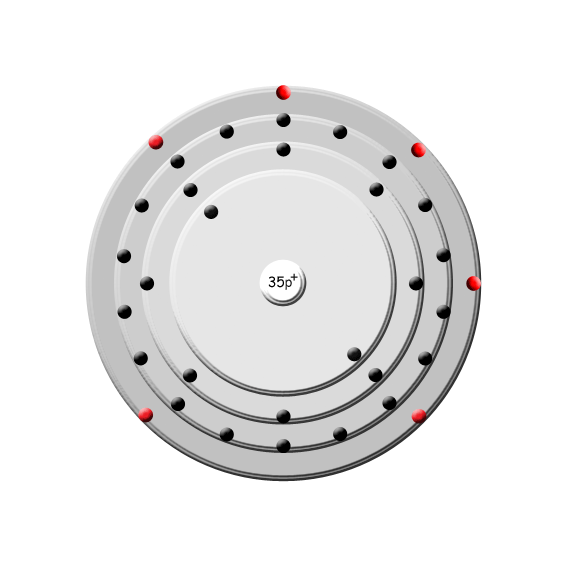
| Brom | |
| 
Bild (zur Verfügung gestellt von www.smart-elements.com) | | Name: | Brom |
| Ordnungszahl: | 35 |
| Atommasse: | 79,904 u |
| Dichte: | 3,122 g/cm3 |
| Schmelzpunkt: | -7,15 °C |
| Siedepunkt: | 59 °C |
|

|
| Iod | |
| 
Bild (zur Verfügung gestellt von www.smart-elements.com) | | Name: | Iod |
| Ordnungszahl: | 53 |
| Atommasse: | 126,9 u |
| Dichte: | 4,93 g/cm3 |
| Schmelzpunkt: | 113,55 °C |
| Siedepunkt: | 184,25 °C |
|

|
| Astat | | [8,3 h] |
| 
Bild (zur Verfügung gestellt von www.smart-elements.com) | | Name: | Astat |
| Ordnungszahl: | 85 |
| Atommasse: | [209,99] u |
| Dichte: | ~ 7 g/cm3 |
| Schmelzpunkt: | 302 °C |
| Siedepunkt: | 337 °C |
|
| | Metall |
| Nichtmetall |
| Halbmetall |
| Lanthanoide |
| Actinoide |
| Künstliche Elemente |
| Feststoff (bei 20 °C) |
Flüssigkeit (bei 20 °C) |
Gas (bei 20 °C) |
[Halbwertszeit] |








